Химические реакции: основные термины
Чтобы понять эту тему, нужно знать определение ключевых терминов.
|
Термин
|
Определение
|
|
Реагенты
|
Вещества, вступившие в реакцию
|
|
Продукт реакции
|
Вещества, образовавшиеся в ходе реакции
|
|
Условия протекания реакции
|
Температура, давление и катализаторы, которые способны ускорить реакцию
|
Важно также знать, что такое катализаторы и ингибиторы. Катализаторами называют вещества, которые не расходуются в ходе реакции, но при этом ускоряют ее. Ингибиторы, наоборот, замедляют реакцию.
Признаки химических реакций
Чтобы визуально отличить химическую реакцию от других процессов, важно знать ее индикаторы:
- Изменение цвета;
- Выпадение (растворение) осадка;
- Выделение газа;
- Излучение света;
- Появление запаха.
Эти признаки указывают на то, что одни вещества преобразовались в другие, которые обладают уже новыми свойствами.
Типы химических реакций
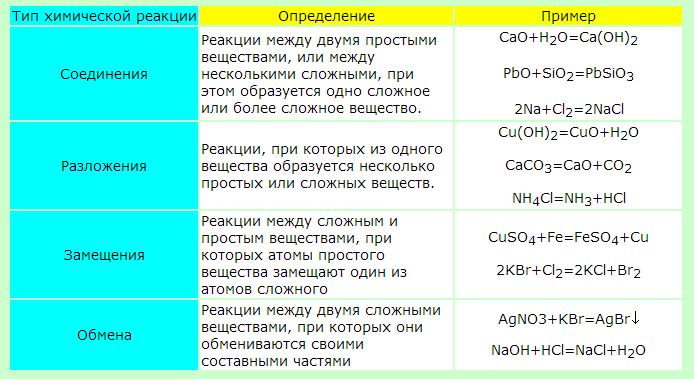
Самая популярная классификация – по числу реагентов и продуктов реакции. Есть несколько типов, о которых нужно знать школьникам:
- Реакции соединения – из нескольких веществ получается одно целое: А + В = АВ (2Cu + O2 = 2CuO)
- Реакции замещения – один элемент замещает другой в составе сложного: А + ВС = АВ + С (2NaBr+Cl2 = 2NaCl+Br2)
- Реакции разложения – из одного целого получается несколько веществ: АВ = А + В (2Cu(NO3)2 = 2CuO+4NO2 +O2)
- Реакции обмена – реакции между сложными веществами, составные части меняются местами: AB + CD = AC + BD (MgCl2+2NaOH = Mg(OH)2+2NaCl).
Обратите внимание на химические реакции и примеры.
Существует еще классификация по тепловому эффекту. В ней есть два типа:
- Экзотермические реакции (+Q), которые протекают с выделением тепла наружу. Это может быть горение, окисление или соединение. Есть два исключения, которые не относятся к вышеперечисленным, но являются экзотермическими:
- (NH4)2Cr2O7=Cr2O3+N2+4H20+Q;
- 2KMnO4=K2Mno4+MnO2+O2+Q.
- Эндотермические реакции (-Q), которые поглощают теплоту. В основном это реакции разложения и две – соединения:
- N2+O2=2NO-Q;
- I2+H2=2HI-Q.
Есть также классификация по изменению степеней окисления. Если степени окисления атомов изменяются, то такую реакцию называют окислительно-восстановительной. Если не изменяются, то это реакция без изменения степеней окисления.
Что такое скорость химической реакции?
Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени. Количество и концентрация реагентов с течением времени уменьшается, а количество продуктов реакции – увеличивается.
Одни реакции протекают в доли секунды (ионные процессы), а другие занимают годы (например, рост сталагмитов). Существуют факторы, влияющие на скорость химической реакции. Таких параметров пять:
- Природа реагирующих веществ. Чем активнее элементы, тем быстрее реакция. Если сравнивать алюминий и железо, то алюминий более активный, это ускоряет реакцию.
- Температура. Чем выше температура, тем молекулы веществ быстрее двигаются, чаще сталкиваются и реакции проходит быстрее.
- Концентрация реагентов. Если кинуть железо в пробирку с кислотой концентрацией 10% и в пробирку с кислотой концентрацией 40%, то во втором случае реакция будет протекать быстрее.
- Катализаторы и ингибиторы, способные ускорять или замедлять реакции.
- Чем больше площадь соприкосновения вещества с водой, тем реакция протекает быстрее. Это правило работает для гетерогенных реакций.

Пятый параметр можно легко проверить в домашних условиях. Для этого понадобится два стакана с теплой водой, кубик сахара и сахарный песок. Нужно одновременно кинуть кубик и рассыпной сахар в воду и наблюдать, что быстрее растворится. Это будет сахар песок, потому что у него намного больше площадь соприкосновения с водой.
Если вы хотите выучить еще больше интересных тем по химии, проводить интересные и захватывающие опыты с наставником, вам нужно подумать об индивидуальных уроках с репетитором по химии. Учитель узнает, с какой целью вы изучаете дисциплину, чтобы разработать индивидуальный план работы и уделить больше времени важным для вас разделам.
Найти репетитора по химии или другому предмету можно на сайте BukiSchool.